- I) Mise en place générale
- 1) Schéma général de l’assimilation des glucides alimentaires
- 2) Régulation de la glycémie
- 3) Transport cellulaire du glucose
- II) Catabolisme glucidique
- 1) La glycolyse (ou voie d’Embden-Meyerhof)
- a) Les différentes étapes de la glycolyse
- b) Bilan énergétique
- c) Régulation de la glycolyse
- 2) Métabolisme du pyruvate
- 3) Le cycle de Krebs
- a) Les différentes étapes du cycle de Krebs
- b) Bilan du cycle de Krebs
- c) Régulation du cycle de Krebs
- 4) Voies annexes
- a) La voie des pentoses-phosphates
- b) La voie du 2,3-diphosphoglycérate (2,3-DPG)
- 1) La glycolyse (ou voie d’Embden-Meyerhof)
- III) Bilan énergétique du catabolisme glucidique
- 1) En anaérobie
- 2) En aérobie
- IV) Réserve glucidique & métabolisme du glycogène
- 1) Glycogénogenèse
- 2) Glycogénolyse
- a) Tissus impliqués
- b) Étapes de la glycogénolyse
- 3) Régulation des réserves de glycogène
- a) Le glucagon et les cathécolamines
- b) l’insuline
- V) Anabolisme glucidique : néoglucogenèse (ou gluconéogenèse)
- 1) Les précurseurs
- 2) Mécanisme d’action et enzymes clé
- VI) Carrefour et interrelation métabolique
- 1) Au niveau de la glycolyse
- 2) Au niveau du cycle de Krebs
- 3) Galactose et fructose
Les glucides ont différents rôle au sein de l’organisme : production énergétique ou mise en réserve, synthèse de glycoprotéines et de macromolécules (GAG, …), synthèse des nucléotides (ribose et NADPH), épuration des produits insolubles et toxiques, interrelation métabolique.
I) Mise en place générale
1) Schéma général de l’assimilation des glucides alimentaires
Au niveau de l’intestin on trouve du glucose provenant des glucides, des acides-aminés provenant des protéines et des chylomicrons provenant des lipides.
Le glucose passe ensuite dans la circulation pour rejoindre les cellules du foie ou hépatocytes, dans lesquelles il sera stocké. Il pourra également être utilisé directement par les cellules de l’organisme en manque d’énergie. En effet le glucose est dégradé dans le cytosol puis dans la mitochondrie en CO2, H2O et ATP (cf. cours Phosphorylation oxydative).
Dans la lumière intestinale on trouve du glucose, du fructose et du galactose qui iront tous les trois au niveau du foie par le sang où ils seront dégradés. Lors d’une trop grande assimilation de sucres le foie sera saturé obligeant l’organisme à les stockés sous forme de graisse au niveau des tissus adipeux.
Par la suite, lorsque l’organisme en aura à nouveau besoin, le foie sera cette fois-ci responsable de la fabrication de glucose à partir de substances non-glucidiques, on parle de la néoglucogenèse (cf. suite du cours).
2) Régulation de la glycémie
La glycémie normale, qui correspond au taux de glucose sanguin, est de 4 à 6 mmol par litre de sang (ou 0,8 g/L).
L’organisme doit pouvoir gérer l’alternance « apport alimentaire-jeûne » et ceci principalement par les sécrétions d’insuline et de glucagon qui sont responsables du maintien permanent de la glycémie par action au niveau des cellules hépatiques. En effet l’organisme n’est jamais à l’équilibre.
- L’insuline est l’hormone de la phase alimentaire, dans le sens où elle sera responsable de la régulation de l’augmentation importante de la glycémie qui suit un repas. Cette diminution de la glycémie est la conséquence de la mise en stock du glucose au niveau du foie sous forme de glycogène, on parle de glycogénogenèse. L’hyperglycémie sera redevenue normale au bout de 3 heures après la fin du repas.
- Le glucagon est l’hormone du jeûne, dans le sens où elle sera responsable de la régulation de la diminution progressive de la glycémie entre deux repas due à la consommation des organes. Cette stabilisation de la glycémie est la conséquence d’une libération de glucose par le foie, on parle de glycogénolyse. On note que le glucagon n’est pas le seul à avoir une action hyperglycémiante, en effet comme dit précédemment il agira principalement au niveau du foie et les catécholamines (adrénaline) agiront principalement au niveau des muscles.
Il est important de faire la remarque ici qu’après un repas la diminution de la glycémie entraînée par l’insuline est trop importante (inférieur à la valeur normale). Ceci peut être expliqué par le faite qu’il existe un temps de latence entre la détection de la variation de la glycémie et les sécrétions hormonales responsable de la stabilisation de la glycémie. De cette manière la sécrétion de glucagon arrive avec un temps de latence après la détection de la diminution de la glycémie, l’insuline continuant son action hypoglycémiante.
3) Transport cellulaire du glucose
Le transport du glucose par diffusion facilitée est une étape limitante du métabolisme cellulaire. Les isoformes de transporteurs ont des affinités variables pour le glucose et l’expression de ces isoformes a une certaine spécificité tissulaire. En effet on trouve des isoformes ubiquitaire (GLUT 1 et 3), c’est-à-dire présentent dans tous les tissus, et des isoformes spécifiques (GLUT 2 et 4) :
- GLUT 1 est principalement visible au niveau des érythrocytes et des neurones,
- GLUT 2 est principalement visible au niveau des hépatocytes et des cellules β des îlots de Langerhans,
- GLUT 3 est principalement visible au niveau des neurones,
- GLUT 4 est principalement visible au niveau des cellules musculaire striées et des adipocytes,
- GLUT 5 est principalement visible au niveau des entérocytes et des spermatozoïdes.
De manière plus localisé, il est important de comprendre les mécanismes d’absorption du glucose au niveau des entérocytes. Au niveau de la bordure en brosse dirigée vers la lumière intestinale, le glucose rentre dans la cellule par un transporteur symport glucose-sodium. Au pôle basal il sera ensuite pris en charge par un transporteur uniport afin de passer dans la circulation sanguine. Le sodium quant-à lui ressortira de la cellule par une pompe sodium-potassium (Na-K ATPase).
II) Catabolisme glucidique
Le catabolisme glucidique correspond à la dégradation des molécules de glucose permettant la formation de molécules riches en énergie.
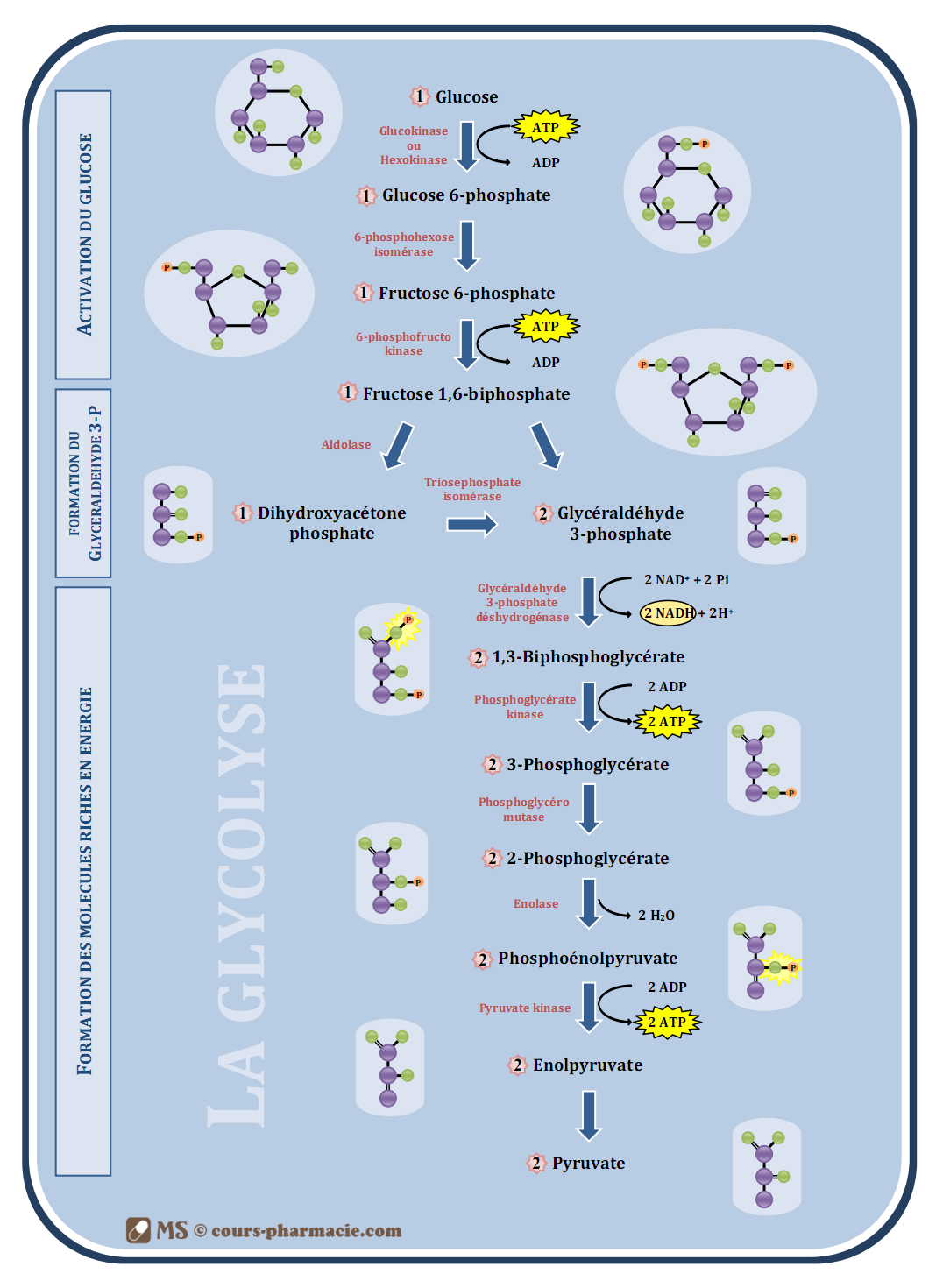
1) La glycolyse (ou voie d’Embden-Meyerhof)
La glycolyse est la première chaîne du catabolisme des glucides, elle s’effectue dans le cytosol par des enzymes solubles et en anaérobie (sans apport d’oxygène). Elle a comme fonction la synthèse de molécule riche en énergie, ainsi que la formation de pyruvate qui aura plusieurs destinées (cf. suite du cours).
a) Les différentes étapes de la glycolyse
La glycolyse est composée de 10 grandes étapes, faisant intervenir 10 enzymes :
- Réaction de transphosphorylation du glucose en glucose-6-phosphate catalysée par la glucokinase au niveau du foie ou par l’hexokinase au niveau des autres organes. Cette réaction consomme une molécule d’ATP.
- Réaction d’isomérisation du glucose-6-phosphate en fructose-6-phosphate catalysée par la 6-phosphohexose-isomérase.
- Réaction de transphosphorylation du fructose-6-phosphate en fructose-1,6-biphosphate catalysée par la 6-phosphofructo-kinase. Cette réaction consomme une molécule d’ATP.
-
- Réaction de dégradation du fructose-1,6-biphosphate en dihydroacétone-phosphate et en gycéraldéhyde-3-phosphate catalysée par l’aldolase.
- Réaction d’isomérisation du dihydroacétone-phosphate en glycéraldéhyde-3-phosphate catalysée par la triosephosphate-isomérase.
- Réaction de phosphorylation du glycéraldéhyde-3-phosphate en 1,3-biphosphoglycérate catalysée par la glycéraldéhyde-3-phosphate-déshydrogénase. Cette réaction nécessite une molécule de phosphate ; elle permet également la formation de NADH, H+ à partir de NAD+.
- Réaction de transphosphorylation du 1,3-biphosphoglycérate en 3-phosphoglycérate catalysée par la phosphoglycérate-kinase. Cette réaction permet la formation d’ATP à partir d’ADP.
- Réaction de mutation du 3-phosphoglycérate en 2-phosphoglycérate catalysée par la phosphoglycéromutase.
- Réaction de déshydrogénation du 2-phosphoglycérate en phosphoénolpyruvate catalysée par l’énolase. Cette réaction relargue une molécule d’H2O.
- Réaction de transphosphorylation du phosphoénolpyruvate en énolpyruvate catalysée par la pyruvate-kinase. Cette réaction permet la formation d’ATP à partir d’ADP.
- Réaction de tautomérie cétone-énol de l’énolpyruvate en pyruvate catalysée par la pyruvate-kinase.
b) Bilan énergétique
La glycolyse peut être divisée en trois grandes parties :
- Activation du glucose avec consommation d’énergie (2 ATP) :
- Le premier du glucose au glucose-6-phosphate.
- Le deuxième du fructose-6-phosphate au fructose-1,6-biphosphate
- Formation du glycéraldéhyde.
- Synthèse du pyruvate et formation de molécules riches en énergie (4 ATP et 2 NADH, H+) :
- Les deux premiers ATP du 1,3-Biphosphoglycérate au 3-Phosphoglycérate.
- Les deux derniers ATP du phosphoénolpyruvate à l’énolpyruvate.
- Les deux NADH, H+ du Glycéraldéhyde-3-phosphate au 1,3-Biphosphoglycérate ; ils permettront chacun d’eux la formation théorique de 2 ATP chacun (en réalité de 1,5 ATP chacun).
Le bilan final théorique est donc de 6 ATP (en réalité de 5 ATP).
c) Régulation de la glycolyse
Dans les voies métaboliques, les enzymes qui catalysent des réactions irréversibles sont des sites potentiels de contrôle. Au niveau de la glycolyse les enzymes sont régulés par trois mécanismes : les régulations par des effecteurs allostériques, les régulations par phosphorylations/déphosphorylation et l’expression des gènes de ces enzymes.
Au niveau de la glycolyse on met en évidence essentiellement trois réactions irréversibles :
- La réaction de transphosphorylation du glucose en glucose-6-phosphate catalysée par la glucokinase ou l’hexokinase. L’hexokinase est inhibée par le glucose-6-phosphate.
- La réaction de transphosphorylation du fructose-6-phosphate en fructose-1,6-biphosphate catalysée par la 6-phosphofructokinase. Cette enzyme est inhibée par l’ATP, le citrate, le glucagon (foie) et l’adrénaline (muscle), et est activé par l’insuline et l’AMP.
- La réaction de transphosphorylation de l’acide phospho-énol-pyruvique en acide énol-pyruvique catalysée par la pyruvate-kinase. Cette enzyme est inhibée par le pyruvate, l’alanine, l’ATP et le NADH, H+.
On retiendra globalement qu’il y a :
- Inhibition de la glycolyse lorsque l’organisme est en excès d’énergie et donc par l’excès d’ATP, le citrate dont la concentration cytosolique augmente, le glucagon, l’adrénaline et l’acidose (cf. suite du cours : 2,3-DPG).
- Activation de la glycolyse lorsque l’organisme est en déficit d’énergie et donc par l’excès d’ADP et d’AMP, l’insuline et l’alcalose (cf. suite du cours : 2,3-DPG).
2) Métabolisme du pyruvate
Suite à la glycolyse les deux pyruvates, formés à partir d’une molécule de glucose, auront plusieurs destinées :
- En aérobie (avec consommation d’O2), le pyruvate aura différents devenirs suivant les besoins de l’organisme :
- Le pyruvate entrera dans la mitochondrie pour être transformé en ACoA (Acétylcoenzyme A). Cette étape sera responsable de la synthèse d’un NADH, H+. L’ACoA aura lui aussi plusieurs destinées :
- Il entrera dans le cycle de Krebs.
- Il jouera le rôle de précurseurs pour des réactions de synthèse (cf. métabolisme des lipides).
- Le pyruvate pourra également jouer un rôle dans la synthèse d’acides aminés.
- Le pyruvate entrera dans la mitochondrie pour être transformé en ACoA (Acétylcoenzyme A). Cette étape sera responsable de la synthèse d’un NADH, H+. L’ACoA aura lui aussi plusieurs destinées :
- En anaérobie (sans consommation d’O2), le pyruvate aura différents devenirs suivant l’organisme dans lequel il se trouve :
- Chez l’Homme, le pyruvate formera de l’acide lactique (lactate) par la lactate-déshydrogénase, avec consommation d’un NADH, H+ (formé au niveau de la glycolyse). Le lactate formé est envoyé continuellement vers le foie permettant ainsi une production rapide d’énergie lors d’un effort important ; une partie de lactate sera également éliminé dans les urines.
- Chez les levures, le pyruvate formera de l’éthanol (fermentation alcoolique) avec également consommation d’un NADH, H+.
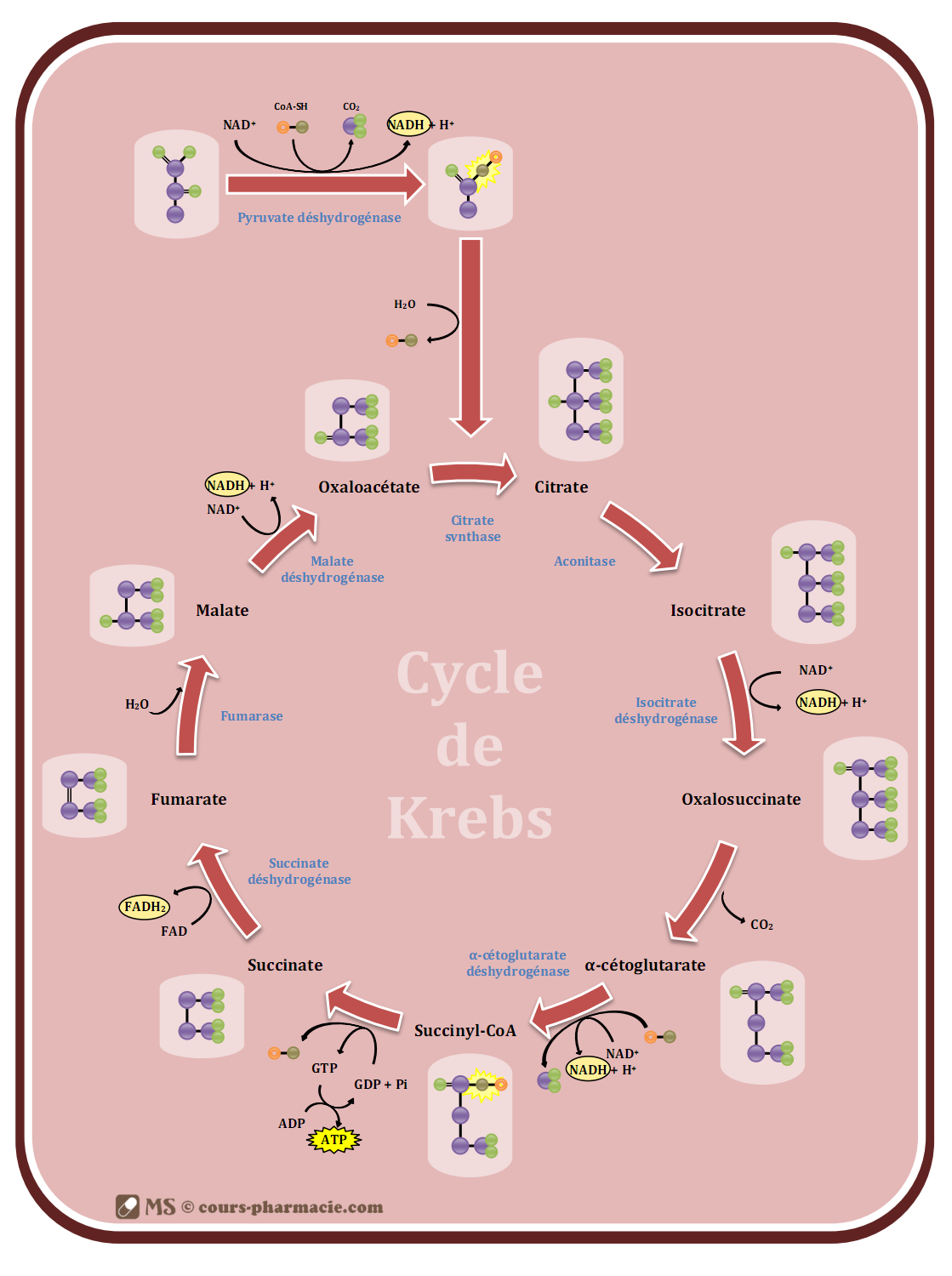
3) Le cycle de Krebs
Le cycle de Krebs (ou cycle tricarboxylique ou cycle de l’acide citrique) est la plateforme énergétique de la cellule, continuant le catabolisme des glucides après la glycolyse. Il se réalise dans la matrice mitochondriale et se fait exclusivement en aérobie.
Le cycle a différents rôles :
- la dégradation du substrat (ACoA) en CO2 grâce à l’oxygène,
- la prise en charge d’hydrogène et d’électrons riches en énergie par les FAD et les NAD+,
- la production d’énergie sous forme d’ATP.
Attention, les érythrocytes (globules rouges) ne possèdent pas d’organites et donc pas de mitochondrie qui est indispensable à la réalisation du cycle de Krebs. De cette manière ils utilisent uniquement l’énergie produite par la glycolyse, le pyruvate sera quant à lui transformé en acide lactique.
a) Les différentes étapes du cycle de Krebs
Le cycle est composé de 9 grandes étapes, faisant intervenir 8 enzymes :
- Réaction de condensation de l’acétylcoenzyme A (ACoA) et de l’oxaloacétate en citrate catalysée par la citrate-synthase. Cette réaction nécessite une molécule d’H2O et relargue une molécule de CoA-SH.
- Réaction d’isomérisation du citrate en isocitrate catalysée par l’aconitase.
- Réaction de déshydrogénation de l’isocitrate en oxalosuccinate catalysée par l’isocitrate-déshydrogénase. Cette réaction permet la formation de NADH, H+ à partir de NAD+.
- Réaction de β-décarboxylation non oxydative de l’oxalosuccinate en α-cétoglutarate. Cette réaction entraîne un dégagement de CO2.
- Réaction de α-décarboxylation oxydative de l’α-cétoglutarate en succinyl-CoA catalysée par l’α-cétoglutarate-déshydrogénase. Cette réaction nécessite une molécule de CoA-SH et entraîne un dégagement de CO2 ; elle permet également la formation de NADH, H+ à partir de NAD+.
- Réaction de transphosphorylation du succiny-CoA en succinate catalysée par la succinate-thiokinase. Cette réaction nécessite une molécule de phosphate et relargue une molécule de CoA-SH ; elle permet également la formation de GTP à partir de GDP.
- Réaction de déshydrogénation du succinate en fumarate catalysée par la succinate-déshydrogénase. Cette réaction permet la formation de FADH2 à partir de FAD.
- Réaction d’hydratation du fumarate en malate catalysée par la fumarase. Cette réaction nécessite une molécule d’H2O.
- Réaction de déshydrogénation du malate en oxaloacétate catalysée par la malate-déshydrogénase. Cette réaction permet la formation de NADH, H+ à partir de NAD+.
b) Bilan du cycle de Krebs
Comme dit précédemment, en aérobie l’acétylcoenzyme A entre dans le cycle de Krebs. Un tour de cycle, c’est-à-dire l’utilisation d’une molécule d’acétylcoenzyme A permet la formation :
- 3 NADH, H+ qui permettront théoriquement la formation de 3 ATP chacun au niveau de la chaîne respiratoire (2,5 ATP en réalité), et donc au total la formation de 9 ATP (7,5 ATP en réalité).
- 1 FADH2 qui permettra théoriquement la formation de 2 ATP au niveau de la chaîne respiratoire (1,5 ATP en réalité).
- 1 ATP.
De cette manière une molécule d’acétylcoenzyme A permet la formation théorique de 12 ATP (10 ATP en réalité).
c) Régulation du cycle de Krebs
Au niveau du cycle de Krebs on met en évidence essentiellement une réaction soumis à régulation, la réaction de déshydrogénation de l’isocitrate à l’oxalosuccinate catalysée par l’isocitrate déshydrogénase. Cette enzyme est inhibée par l’excès d’ATP et activée par le NAD et le FAD.
D’autre part la régénération d’oxaloacétate est nécessaire pour que le cycle de Krebs fonctionne à flux constant. En effet l’oxaloacétate joue un rôle dans un certain nombre de métabolisme, son apport régulier au cycle de Krebs est permis par les acides aminés (cf. suite du cours).
4) Voies annexes
a) La voie des pentoses-phosphates
La voie des pentoses-phosphates se réalise en parallèle à la glycolyse et permet la formation de pentose-phosphate indispensable à la biosynthèse d’acides nucléiques (ADN et ARN) et la formation de NADPH, H+ pour les réactions de biosynthèse (cf. document annexe).
b) La voie du 2,3-diphosphoglycérate (2,3-DPG)
La voie du 2,3-diphosphoglycérate (2,3-DPG) se réalise au niveau des érythrocytes (globules rouges) et correspond à une voie de stockage du glucose mais dans de moindre mesure que le glycogène.
Elle se met en place à partir de la glycolyse ; on est face à deux situations :
- Lorsque la cellule est en présence d’un excès de glucose, on observe une accumulation de 2,3-diphosphoglycérate, par transformation du 1,3-diphosphoglycérate en 2,3-diphosphoglycérate, réaction catalysé par une mutase.
- D’autre part lorsque les besoins énergétique des érythrocytes le demande, on observe l’activation de la phosphatase responsable de la dégradation du 2,3-diphosphoglycérate en 3-phosphoglycérate permettant la poursuite de la glycolyse.
Le 2,3-DPG joue également un rôle dans la régulation du transport de l’oxygène par l’hémoglobine. En effet, le 2,3 DPG étant un anion fortement polaire il se lie à la désoxyhémoglobine et diminue ainsi l’affinité de l’hémoglobine pour l’O2.
On peut faire la remarque ici que le pH est un des facteurs qui influencent la teneur en 2,3-DPG des érythrocytes. En effet l’acidose au niveau des poumons, inhibe la glycolyse et donc la synthèse de 2,3-DPG permettant à l’O2 de se fixer, et inversement au niveau des tissus.
III) Bilan énergétique du catabolisme glucidique
On considérera ici la dégradation d’une molécule de glucose par la glycolyse et le cycle de Krebs, sans prendre en compte les voies annexes.
1) En anaérobie
- Bilan de la glycolyse : formation de 2 ATP et de 2 NADH, H+ (qui seront utilisés dans la formation du lactate ; cf. suite du cours).
- Bilan du catabolisme du pyruvate : catabolisme impossible en anaérobie !
- Bilan du cycle de Krebs : en anaérobie le cycle de Krebs ne fonctionne pas !
- Bilan de la formation de lactate : les deux molécules de pyruvate formées par la glycolyse sont dégradées en lactate, nécessitant chacune un NADH, H+ (ceux formés lors de la glycolyse).
Le bilan global de la dégradation d’une molécule de glucose en anaérobie est donc de 2 ATP qui sont immédiatement mobilisable.
2) En aérobie
- Bilan de la glycolyse : formation théorique de 6 ATP (5 ATP en réalité).
- Bilan du catabolisme du pyruvate : formation de 3 ATP par molécule de pyruvate en théorie (2,5 en réalité) et donc de 6 ATP en théorie (5 ATP en réalité) pour une molécule de glucose.
- Bilan du cycle de Krebs : en théorie 12 ATP par molécule d’acétylcoenzyme A (10 ATP en réalité) et donc en théorie 24 ATP (20 ATP en réalité) pour une molécule de glucose.
Le bilan global théorique de la dégradation d’une molécule de glucose en aérobie est donc de 36 ATP (30 ATP en réalité) qui ne sont pas immédiatement mobilisable car la majorité des ATP formés proviennent de la phosphorylation oxydative.
Il est important de préciser ici que certains ouvrages parlent d’un bilan global théorique de 38 ATP ; cette différence est explicable par le type de navette utilisée (cf. cours Phosphorylation oxydative).
IV) Réserve glucidique & métabolisme du glycogène
1) Glycogénogenèse
La glycogénogenèse correspond au stockage du glucose sous forme d’un polysaccharide (polymère de glucose), appelé le glycogène. La synthèse du glycogène se réalise au niveau du cytosol par un enzyme appelée la glycogène-synthase.
Le glucose est tout d’abord phosphorylé pour donner le glucose-6-phosphate qui sera isomérisé en glucose-1-phosphate, lui-même activé par de l’UTP (uridine triphosphate) entraînant la formation d’UDP-glucose ; ces deux premières étapes consomment 2 ATP.
Une fois activés les UDP-glucoses se lient les uns après les autres à la chaîne en voie d’élongation. Après la fixation d’un certain nombre de résidus glycosyles, la glycosyl-4,6-transférase (ou enzyme branchante) transfère un bloc de 5 à 8 unités en C6 d’un résidu d’au moins 11 unités entraînant la formation d’une ramification ; la synthèse reprend ensuite jusqu’à l’obtention du polysaccharide désiré.
Cette réaction de branchement a deux conséquences sur le glycogène :
- L’augmentation de la solubilité.
- L’augmentation du nombre de résidus terminaux permettant un recrutement plus rapide des unités glucidique lors d’un besoin énergétique.
2) Glycogénolyse
a) Tissus impliqués
La glycogénolyse est la réaction inverse de la glycogénogenèse et se réalise principalement dans le foie et dans les muscles, mais à des fins différentes :
- Le foie joue un rôle dans le maintien de l’homéostasie, et ceci grâce à différentes caractéristiques :
- La présence de transporteurs du glucose insulinodépendants,
- La présence de récepteurs au glucagon,
- La présence de l’enzyme glucose-6-phosphatase. Cette dernière enzyme donne la caractéristique du foie d’être le seul à pouvoir libérer en quantité du glucose dans le sang.
- Les muscles stockent le glucose pour une utilisation ultérieure. En effet ils ne peuvent en aucun cas reverser du glucose dans le sang pour d’autres organes, ne possédant pas la glucose-6-phosphatase permettant le retour au glucose et les transporteurs membranaires étant spécifiques du glucose ne permettent pas le passage de glucose-6-phosphate. De cette manière tout le glucose entrant dans les muscles est strictement utilisé par les muscles.
b) Etapes de la glycogénolyse
La glycogénolyse se réalise en trois étapes principales :
- Tout d’abord le glycogène est lesté d’une unité par la glycogène-phosphorylase, entrainant la formation de glucose-1-phosphate. Cette étape se fera dans le cytosol.
- Le glucose-1-phosphate est ensuite isomérisé en glucose-6-phosphate, réaction catalysé par la phospho-glucomutase. Cette étape se fera également dans le cytosol.
- Et finalement le glucose-6-phosphate est transformé en glucose par la glucose-6-phosphatase, et ceci au niveau du réticulum endoplasmique des cellules hépatiques, les seules à posséder cette enzyme.
La glycogénolyse permet donc la formation de glucose-6-phosphate sans consommation d’ATP.
Remarque :
L’hydrolyse complète du glycogène demande l’intervention d’une transférase et de l’α-1,6-glucosidase (ou enzyme débranchante), responsables de la dégradation des nœuds de ramifications formés lors de la glycogénogenèse.
3) Régulation des réserves de glycogène
La glycogénolyse et la glycogénogenèse sont des mécanismes inverses et alternatifs qui sont dirigés par des signaux régulateurs importants qui lorsqu’ils activent l’un, ils inhibent l’autre. La glycogénolyse et la glycogénogenèse ne peuvent donc pas avoir lieu en même temps.
a) Le glucagon et les catécholamines
En effet, les catécholamines (adrénaline) au niveau des muscles et le glucagon au niveau du foie entraînent l’activation de protéines kinases qui auront deux fonctions différentes mais complémentaires :
- La phosphorylation de la glycogène-synthase active pour la désactiver, stoppant ainsi la glycogénogenèse.
- La phosphorylation de la phosphorylase-kinase inactive pour l’activer, déclenchant ainsi la glycogénolyse.
b) L’insuline
L’insuline aura un effet inverse au niveau du foie et ceci en agissant à différent niveau de la mise en réserve du glucose sous forme de glycogène :
- L’insuline et l’augmentation de glucose (et donc de glucose-6-phosphate) entraîne l’activation de la glucokinase (foie), induisant une diminution de la glycémie. On note que l’hexokinase, qui a la même fonction catalytique que la glucokinase, est moins spécifique d’un tissu et est inhibée par le glucose-6-phosphate.
- L’insuline entraîne l’activation de phosphatases qui auront deux fonctions différentes mais complémentaires :
- La déphosphorylation de la glycogène-synthase inactive pour l’activer, déclenchant ainsi la glycogénogenèse.
- La déphosphorylation de la phosphorylase-kinase active pour la désactiver, stoppant ainsi la glycogénolyse.
V) Anabolisme glucidique : néoglucogenèse (ou gluconéogenèse)
La néoglucogenèse est l’inverse de la glycolyse, en effet elle permet la production de glucide et ceci à partir de précurseurs non glucidiques. Elle est réalisée au niveau du cytosol, majoritairement au niveau du foie mais également au niveau du rein (principalement à partir d’acides aminés).
La néoglucogenèse est activée lors d’une période de jeûne prolongé, lorsque les nutriments apportés par la nutrition ainsi que les stocks de glycogène ne permettent plus de satisfaire les besoins énergétiques de l’organisme. On observe dans cette situation un manque d’ATP ainsi que excès d’AMP.
1) Les précurseurs
Les précurseurs non glucidiques sont de différents types :
- le lactate formé au niveau des muscles et transformé en pyruvate par l’action de la lactate-déshydrogénase.
- les acides-aminés glucoformateurs provenant de l’alimentation et de la dégradation des protéines des muscles squelettique. Parmi eux on compte l’alanine (pour 40 à 60%), la sérine, la cystéine, la thréonine, la glycine, la tyrosine, la phénylalanine et l’isoleucine.
- le glycérol provenant de la dégradation des triglycérides au niveau des cellules adipeuses.
Ces précurseurs sont tout d’abord convertis en des intermédiaires de la glycolyse : le pyruvate pour le lactate et les acides aminés ; le dihydroacétone pour le glycérol.
2) Mécanisme d’action et enzymes clé
La néoglucogenèse n’est en fait pas exactement l’inverse de la glycolyse dans le sens où certaines réactions de la glycolyse sont irréversibles (cf. plus haut dans le cours). Afin que la néoglucogenèse fonctionne des alternatives ont dues être trouvées. Dans ce sens il a été mis en place trois mécanismes nécessitant trois enzymes caractéristiques :
- Le passage du pyruvate au phosphoénolpyruvate catalysé par la phosphoénolpyruvate-carboxykinase se fait indirectement. En effet cette réaction est contournée à partir du malate qui a la possibilité de sortir de la mitochondrie par la navette malate-aspartate et d’être retransformé en oxaloacétate au niveau du cytosol. L’oxaloacétate sera lui-même transformé en phosphoénolpyruvate par la phosphoénolpyruvate-carboxykinase.
- Le passage du fructose-1,6-biphosphate au fructose-6-phosphate catalysé par la fructose-1,6-biphosphatase se fait directement.
- Le passage du glucose-6-phosphate au glucose catalysé par la glucose-6-phosphatase se fait directement. Il est important de noter que cette enzyme est uniquement présente au niveau du foie, qui sera donc le seul organe à pouvoir libérer du glucose dans le sang.
VI) Carrefour et interrelation métabolique
Il est important de préciser que les différentes voies métaboliques ne sont pas isolées les unes des autres mais qu’il existe des liens entre elles.
1) Au niveau de la glycolyse
On observe des relations avec les stocks glucidiques de la cellule : la dégradation du glycogène entraîne la formation de glucose-6-phosphate.
On observe des relations avec la voie des pentoses-phosphate :
- Le glucose et le glucose-6-phosphate rentre dans la voie des pentoses-phosphate.
- Le fructose-6-phosphate et le glycéraldéhyde-3-phosphate sont synthétisés par la voie des pentoses-phosphates.
On observe des relations avec le métabolisme des lipides : le glycérol formé suite à la dégradation des triglycérides peut former du glycéraldéhyde-3-phosphate (et inversement).
2) Au niveau du cycle de Krebs
On observe des relations avec le métabolisme des lipides : la dégradation des acides gras entraîne la formation d’acétylcoenzyme A.
Il est important de noter ici qu’au niveau du cycle de Krebs le citrate se transforme défavorablement en isocitrate ; de cette manière on sera face à deux situations :
- un manque d’ATP poussera le cycle de Krebs à se poursuivre,
- un excès d’ATP poussera le citrate à sortir de la mitochondrie permettant la reformation d’acétylcoenzyme A qui entrera dans la formation des acides gras. Le citrate aura également un rôle d’inhibition de la 6-phosphofructokinase et donc de la glycolyse.
On observe des relations avec le métabolisme des protéines : la dégradation des protéines peut entraîner la formation de pyruvate, d’acétylcoenzyme A, d’α-cétoglutarate, de fumarate et d’oxaloacétate. Inversement le pyruvate peut également être à l’origine de la formation d’acides aminés.
Comme dit précédemment le malate peut traverser la membrane interne de la mitochondrie par la navette malate-aspartate pour aller dans le cytosol et reformer du glucose. Certains acides aminés joueront ainsi un rôle important dans la néoglucogenèse, on parle d’acide aminés glucoformateurs.
Remarque :
Le pyruvate peut être également reformé à partir d’alcools et de lactate.
3) Galactose et fructose
On remarque que le galactose et le fructose ne sont pas stockés dans l’organisme, ils proviennent de l’alimentation et rejoignent le métabolisme du glucide au niveau de la voie de réserve ou au niveau de la glycolyse suivant les tissus. On note également que le galactose et le fructose ne sont pas soumis à une régulation hormonale.
Le galactose peut rentrer dans la voie de réserve du glucose, l’UDP-galactose étant en équilibre avec l’UDP-glucose, réaction catalysé par l’UDP-galactose-épimérase et peut rentrer dans la voie de la glycolyse par isomérisation entre le galactose-6-phosphate et le glucose-6-phosphate.
Le fructose possède un catabolisme beaucoup plus rapide que le glucose, surtout grâce à la fructokinase qui a une activité beaucoup plus importante que la glucokinase. Le fructose peut également participer à la voie de réserve, le fructose-6-phosphate étant en équilibre avec le glucose-6-phosphate, réaction catalysé par la phospho-hexose-isomérase. La plupart du fructose est métabolisé au niveau du foie en fructose 1-phosphate qui sera scindé en glycéraldéhyde et dihydroacétone afin de rejoindre la voie de la glycolyse.